1/6ページ
ダウンロード(2.2Mb)
分子工学と抗体ヒト化において飛躍的発展を遂げているモノクローナル抗体(mAb)は、ほとんどの臨床適応において急成長しているバイオ医薬品クラスの1つとなっています。
当アプリケーションノートでは、ImmunoPrecise Antibodies社が抗体発見プロセスでどのように「iQue フローサイトメトリー」を利用しているのかをご紹介しています。是非ご一読ください。
【掲載内容】
■はじめに
■方法
■結果と考察
■結論
※詳しくはPDF資料をご覧いただくか、お気軽にお問い合わせ下さい。
このカタログについて
| ドキュメント名 | 【アプリケーションノート】抗体発見ワークフローの効率化 |
|---|---|
| ドキュメント種別 | ホワイトペーパー |
| ファイルサイズ | 2.2Mb |
| 登録カテゴリ | |
| 取り扱い企業 | ザルトリウス・ジャパン株式会社 (この企業の取り扱いカタログ一覧) |
この企業の関連カタログ

このカタログの内容
Page1
アプリケーションノート
2018
キーワードまたはキーフレーズ:
モノクローナル抗体(mAb)、治療用抗体、
抗体の発見と開発、抗体発見ワークフロー、
iQue、高度フローサイトメトリー、
ImmunoPrecise Antibodies社、細胞株の生成、
抗体特性解析、抗体プロファイリング、
ハイブリドーマスクリーニング、血清評価
ImmunoPrecise Antibodies社における
抗体発見ワークフローの効率化
はじめに
分子工学と抗体ヒト化において飛躍的発展を遂げているモノクローナル抗体(mAb)は、ほとんどの臨床適応において最も急
成長しているバイオ医薬品クラスの1つとなっています。2017年、EUとアメリカでは合計10の治療用モノクローナル抗体が承認
されており、さらに9つの候補が規制審査中で、60が第III相治験の段階にありました1。mAbは、多数の治療法のバックボーン
であり、非結合治療用抗体、抗体薬物複合体、二重特異性抗体、CAR-T細胞療法などの中心となっています。承認済み抗体
医薬の多くは、同じ標的と関連しているか、1つのシグナル伝達経路の複数の構成因子を標的としています。例えば、複数の
承認済み抗体医薬がヒト上皮成長因子受容体2(HER2)、B細胞抗原CD20、programmed cell death-1(PDL1)を標的
としていますが、作用機序、抗原エピトープ、抗体フォーマットはさまざまです。このような競争の激しい状況により、作用機序、
薬物動態、送達システムが改良された、新たな標的を持つ次世代抗体医薬の創出に対する医薬開発者らの意欲が高まって
います(Reviewed, 2)。
次世代の抗体医薬では、Gタンパク質共役受容体(GPCR)など、さらに困難な治療標的に焦点を当てているため、大規模
スクリーニング戦略を実施するためのハイスループット法や、大量のマルチプレックスデータセットを簡単に解析できるソフトウェア
の使用が必要となっています。iQue® フローサイトメトリープラットフォームは、抗体の発見と開発を前進させる実用的な結果を
迅速に得られる統合ソリューションです。iQue® プラットフォームでは、ハイスループットサンプリング、フローサイトメトリー検出、
そしてプレートレベルの解析が可能な内蔵解析ソフトウェアが統合されており、384ウェルプレートでは20分未満のサンプリング
時間で多くの情報が得られます。従来のフローサイトメトリーのデッドボリュームをなくすことで、アッセイ容量をマイクロリットル
レベルまで減らすことができたため、貴重な細胞や試薬でコストを削減できます。データの取得、解析、可視化は、ユーザー
定義のテンプレートを用いてプレートごとに臨機応変に実施することができるため、役に立つ結果を得るための時間と労力を
大幅に減らすことができます。
詳細はこちら:www.sartorius.com/intellicyt
Page2
このアプリケーションノートでは、ImmunoPrecise Antibodies社(旧ModiQuest Research社)が抗体発見プロセスで
どのようにiQue® フローサイトメトリーを利用しているのかをご紹介します。ImmunoPrecise Antibodies社における抗体
発見ワークフローは以下の3つの段階に分けられます:
1. 標的抗原を高い表面レベルで発現できる細胞株を産生するための標的細胞株の改変
2. 複数の抗原型でのマウスの免疫化と、標的抗原への結合を調べるための免疫血清の検査
3. 抗体結合と標的特異性に関するハイブリドーマクローンの大規模スクリーニング
方法
細胞株の生成 ハイブリドーマの生成
特異性アッセイと免疫化のための細胞株は、レンチウイルス 脾臓B細胞は、電気融合により骨髄腫細胞と融合し、384ウェル
を用いた遺伝子導入により作製されました。抗原と関連抗原 プレートで培養し、HAT培地で増殖させて融合細胞株のみ
の細胞表面解析は、シングルセルクローニングの前に間接 を選択しました。上清は、培養14日後に抗体結合を測定し
免疫蛍光法によりプールした細胞で確かめられました。遺伝 ました。
子導入されていない親細胞と関連抗原を発現する細胞は、
ネガティブコントロールとして使用しました。3種類の細胞株 データの取得と解析
のマルチプレックスのために、異なる強度の蛍光色素で細胞 全データはiQue® プラットフォームを用いて取得し、データは
を染色しました。これらの細胞を混合し、マイクロタイター iQue Forecyt® ソフトウェアを用いて解析しました。マルチ
プレートの同一ウェルに分注しました。3つの細胞株それぞ プレート試験のヒートマップとプロファイルマップは、
れを蛍光強度で区別し、血清試験とハイブリドーマスクリー Panorama機能を使って可視化しました。
ニング試験で抗体結合を分析しました。
免疫化
BALB/cマウスは、さまざまな免疫原を用いるプライム
ブースト戦略で免疫化しました。免疫前血清と免疫後の2つ
の時点における免疫血清について、抗体産生を評価しました。
結果と考察
安定な細胞株の産生
細胞表面において本来の構造で表面抗原を発現することが オーバーレイヒストグラムプレートビュー(図1A)は各クローン
できることで、細胞ベースの免疫化、結合試験、機能試験 (赤)からの抗原発現レベルを示しており、親細胞からの
などを含めた抗体発見があらゆる面で容易になります。しか バックグラウンド発現は灰色で示しています。細胞数は各ウェ
しながら、多くのタンパク質は発現が難しく、何百ものクローン ルで評価しました(データ未掲載)。どの細胞クローンを使っ
のスクリーニングが必要です。iQue® システムでは、96ウェル ていくのかを決定するため、プロファイルマップをPanorama
プレートあたりわずか5分で多数の細胞クローンからの抗原 で作成します。抗体発現に基づく上位25のクローンが示され
発現を迅速に測定することができます。抗体発現アッセイを ます(図1B)。抗原特異性を決定するために必要である関連
小型化できることで、ワークフローの早い段階で細胞株を 抗原でも同様の試験を実施しました(データ未掲載)。次に、
スクリーニングすることができ、結果までの時間が短縮され 細胞数で上位25の発現クローンをランク付けしました。この
ます。 試験では、安定な細胞株を評価しましたが、別の試験では
一過的に遺伝子導入した細胞が使用されており、細胞株
安定な細胞株を開発するために、抗原発現コンストラクトを 生産における柔軟性が得られました。
含むレンチウイルス粒子で細胞に形質導入しました。シングル
セルクローンを選択環境下で約2週間増殖させ、半数の細胞
をアッセイプレートに移しました。細胞を洗浄し、抗原特異
的蛍光抗体を添加し、パラホルムアルデヒドで細胞を固定し
ました。
2
Page3
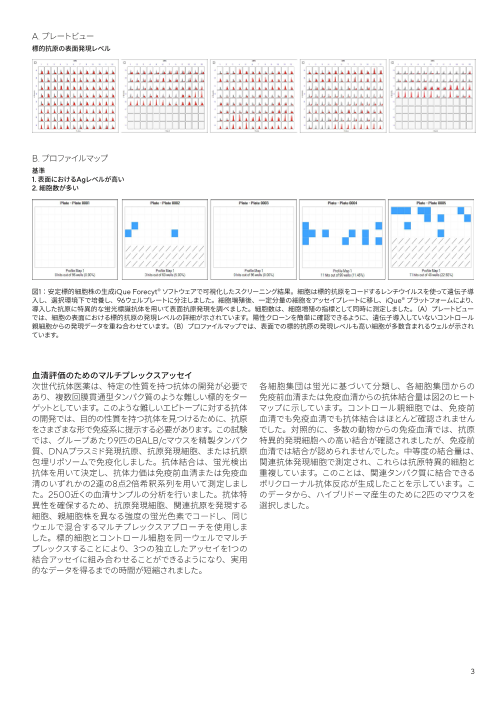
A. プレートビュー
標的抗原の表面発現レベル
B. プロファイルマップ
基準
1. 表面におけるAgレベルが高い
2. 細胞数が多い
図1:安定標的細胞株の生成iQue Forecyt® ソフトウェアで可視化したスクリーニング結果。細胞は標的抗原をコードするレンチウイルスを使って遺伝子導
入し、選択環境下で培養し、96ウェルプレートに分注しました。細胞増殖後、一定分量の細胞をアッセイプレートに移し、iQue® プラットフォームにより、
導入した抗原に特異的な蛍光標識抗体を用いて表面抗原発現を調べました。細胞数は、細胞増殖の指標として同時に測定しました。(A)プレートビュー
では、細胞の表面における標的抗原の発現レベルの詳細が示されています。陽性クローンを簡単に確認できるように、遺伝子導入していないコントロール
親細胞からの発現データを重ね合わせています。(B)プロファイルマップでは、表面での標的抗原の発現レベルも高い細胞が多数含まれるウェルが示され
ています。
血清評価のためのマルチプレックスアッセイ
次世代抗体医薬は、特定の性質を持つ抗体の開発が必要で 各細胞集団は蛍光に基づいて分類し、各細胞集団からの
あり、複数回膜貫通型タンパク質のような難しい標的をター 免疫前血清または免疫血清からの抗体結合量は図2のヒート
ゲットとしています。このような難しいエピトープに対する抗体 マップに示しています。コントロール親細胞では、免疫前
の開発では、目的の性質を持つ抗体を見つけるために、抗原 血清でも免疫血清でも抗体結合はほとんど確認されません
をさまざまな形で免疫系に提示する必要があります。この試験 でした。対照的に、多数の動物からの免疫血清では、抗原
では、グループあたり9匹のBALB/cマウスを精製タンパク 特異的発現細胞への高い結合が確認されましたが、免疫前
質、DNAプラスミド発現抗原、抗原発現細胞、または抗原 血清では結合が認められませんでした。中等度の結合量は、
包埋リポソームで免疫化しました。抗体結合は、蛍光検出 関連抗体発現細胞で測定され、これらは抗原特異的細胞と
抗体を用いて決定し、抗体力価は免疫前血清または免疫血 重複しています。このことは、関連タンパク質に結合できる
清のいずれかの2連の8点2倍希釈系列を用いて測定しまし ポリクローナル抗体反応が生成したことを示しています。こ
た。2500近くの血清サンプルの分析を行いました。抗体特 のデータから、ハイブリドーマ産生のために2匹のマウスを
異性を確保するため、抗原発現細胞、関連抗原を発現する 選択しました。
細胞、親細胞株を異なる強度の蛍光色素でコードし、同じ
ウェルで混合するマルチプレックスアプローチを使用しま
した。標的細胞とコントロール細胞を同一ウェルでマルチ
プレックスすることにより、3つの独立したアッセイを1つの
結合アッセイに組み合わせることができるようになり、実用
的なデータを得るまでの時間が短縮されました。
3
Page4
マウス番号
免疫前血清
コントロール
細胞
免疫後血清
免疫前血清
無関係の
抗原
免疫後血清
免疫前血清
標的抗原
免疫後血清
図2:マウス血清評価のためのマルチプレックスアッセイiQue Forecyt® ソフトウェアのヒートマップ機能を用いて可視化された試験結果。3つの細胞株は、
iQue® 蛍光色素で色分けし、混合して、384ウェルプレートのウェルに分注しました。各ウェルに血清サンプルを添加後、蛍光検出抗体を添加し、プレート
をiQue® プラットフォームで解析しました。標的抗原での免疫前と免疫後のマウス36匹からの血清は、8倍希釈において2連で調べました。ヒートマップは、
コントロール細胞、標的抗原発現細胞、無関係の関連抗原を発現する細胞に結合する抗体の結果を示しています。
マルチプレックスハイブリドーマスクリーニングアッセイ
ハイブリドーマスクリーニングは、多くの場合、全細胞また 全スクリーニングプロセスとデータ解析は、1日以内に完了し
はペプチドベースのELISAを用いて実施されます。しかしなが ました。
ら、ELISAは時間がかかるシングルエンドポイントのアッセイ
で、特に立体構造エピトープを認識する抗原の場合には、 3種類の細胞集団の抗体結合ヒートマップは図3に示してま
バインダーの数が過小評価されることがあります。さらに、 す。マウス2では、マウス1よりも特異的バインダーがはるか
陽性ELISAデータはセルベースアッセイで確認を取る必要が に多いことが明らかであり、免疫化に使用された抗原型の
あります。ハイブリドーマスクリーニングを加速させるために、 違いがある可能性が反映されています。プロファイルマップ
複数のセルベース結合アッセイが実施されました。ハイブリ では、ハイブリドーマ上清がユーザー定義基準を上回る抗原
ドーマは、抗体力価アッセイで特定された2匹のマウスから 発現細胞(青色)に特異的に結合しているヒット(マウス1
作製されました。特定される抗体リード数を最大限にするた では約0.15%、マウス2では約1%)を確認できます。この研究
めに、9600のハイブリドーマを384ウェルプレート25枚に では、特異性を測定するために抗原と関連抗原を発現する
配置し、解析前の14日間増殖させました。ハイブリドーマク 細胞を使用しましたが、その他のハイブリドーマスクリーニング
ローンからの上清は、抗体の結合と特異性を測定するため 試験では動物モデルを用いる前臨床試験を円滑に進めるた
に抗体力価アッセイで使用された3つのコード細胞株と混合 めに異なる種の抗原を発現する細胞が使用されました。
しました。 iQue® システムにおけるアッセイ小型化のために 別の方法として、さまざまな抗原と結合したビーズを用いる
必要な上清が少量であったため、反復試験やダウンストリーム マルチプレックススクリーニングもハイブリドーマスクリー
機能アッセイに使用できる過剰量の上清が利用可能となり、 ニングアッセイのために使用されています。
コストの削減と抗体発見プロセスの加速が実現しました。
4
Page5
マウス1
コントロール
細胞
無関係の
ヒート 抗原
マップ
標的抗原
プロファイル
マップ
マウス2
コントロール
細胞
無関係の
ヒート 抗原
マップ
標的抗原
プロファイル
マップ
図3:マルチプレックスハイブリドーマスクリーニング。iQue Forecyt® ソフトウェアのPanorama機能を用いて可視化した全スクリーニングの結果。3つの
細胞株は、iQue® cell encoder dyeで色分けし、混合し、384ウェルプレートのウェルに分注しました。各ウェルにハイブリドーマ上清を添加後、蛍光
検出抗体を添加し、プレートをiQue® プラットフォームで解析しました。標的抗原発現細胞で免疫化した2匹のマウスからの9,600のハイブリドーマを調べ
ました。スクリーニング全体は1日で完了しました。コントロール細胞、標的抗原発現細胞、無関係の関連抗原を発現する細胞に結合する抗体の結果-を示す
ヒートマップ(赤色)。プロファイルマップ(青色)では、3つの細胞型への結合結果が統合されており、標的抗原発現細胞に結合し、無関係の抗原を発現
する細胞やネガティブコントロール細胞には結合しない抗体が示されています。
結論
ImmunoPrecise Antibodies社(旧ModiQuest社)では、 リアルタイムのマルチプレートデータ解析にあります。マルチ
リード作製までの時間を短縮するために抗体発見の複数の プレックス細胞解析では、複数のアッセイが組み合わされて
段階でiQue® フローサイトメトリープラットフォームを使用 1つの試験になっているため、抗体スクリーニングワークフロー
しています。ImmunoPrecise Antibodies社とその顧客に が簡略かつ迅速になります。アッセイ小型化によりコストが
とって、iQue® プラットフォームと統合iQue Forecyt® ソフト 削減し、貴重な抗体上清の使用量を減らして追加の確認試験
ウェアの価値は、迅速なハイスループットサンプリングと や機能試験のために使用することができます。
参考文献
1. Kaplon H and Reichert JM. Antibodies to Watch in
2018. mAbs, 1-21 (2018)
2. Carter PJ and Laazar GA. Next Generation antibody
Drugs: Pursuit of the �High-Hanging Fruit.� Nature
Reviews, Drug Discovery, 17;197-223 (2018)
5
Page6
ザルトリウス・ジャパン株式会社
東京本社 名古屋営業所 大阪営業所
〒140-0001 〒461-0002 〒532-0003
東京都品川区北品川1-8-11 名古屋市東区代官町35-16 大阪市淀川区宮原4-3-39
Daiwa 品川North ビル4 階 Phone: 03 6478 5204
Phone: 03 6478 5200 Fax: 03 6478 5494 Fax: 03 6478 5497
Email: hp.info@sartorius.com
F or further contacts, visit
www.sartorius.com
研究にのみ使用できます。体外診断での使用はできません。
掲載されている内容は、予告なく変更される場合がありますことをあらかじめご了承ください。
© 2020, Essen BioScience, Inc., part of the Sartorius Group.All Rights Reserved.
Intellicyt, iQue, iQue3, Forecyt, and all names of Intellicyt products are registered
trademarks and the property of Essen BioScience unless otherwise specified. Intellicyt
is a Sartorius brand.Printed in the EU or US on paper bleached without chlorine.
Publication No.: 12690 Version 2: 10 | 2020