1/24ページ
ダウンロード(1.8Mb)
微量サンプル用固相抽出カラム
MonoSpinは、均一な連続孔を持つシリカモノリスを用いた前処理用スピンカラムです。
・遠心処理による簡単操作
・高い通液性を持つ構造による高速処理が可能
・100 μL以下の溶出量でも優れた再現性
このカタログについて
| ドキュメント名 | MonoSpin(微量サンプル用固相抽出カラム) |
|---|---|
| ドキュメント種別 | 製品カタログ |
| ファイルサイズ | 1.8Mb |
| 登録カテゴリ | |
| 取り扱い企業 | ジーエルサイエンス株式会社 (この企業の取り扱いカタログ一覧) |
この企業の関連カタログ

このカタログの内容
Page1
微量試料の精製・濃縮用カラム MonoSpinシリーズ
2020年1月改訂
Contents
MonoSpin とは........................................................................2
MonoSpin シリーズラインアップ...................................4
MonoSpin シリーズの特長.................................................5
アプリケーション...................................................................7
リン酸脂質吸着カラム
MonoSpin Phospholipid .................................................. 13
抗体精製用カラム
MonoSpin ProA , ProG ...................................................... 16
MonoSpin 96 ウェルプレート........................................ 20
アクセサリー......................................................................... 21
MonoSpin シリーズ価格表.............................................. 22
微量試料の精製・濃縮カラム
MonoSpin
Solid Phase Extraction Spin Column
微量サンプルの精製濃縮を
簡易な遠心処理により実現
Page2
スライド番号 2
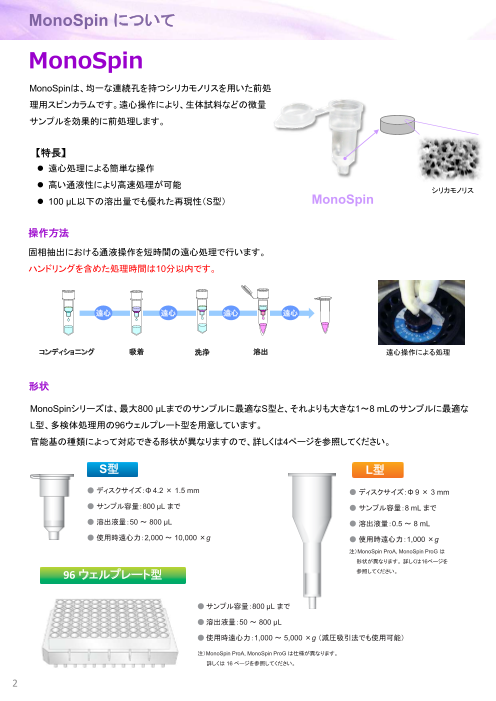
MonoSpin について
MonoSpin
MonoSpinは、均一な連続孔を持つシリカモノリスを用いた前処
理用スピンカラムです。遠心操作により、生体試料などの微量
サンプルを効果的に前処理します。
【特長】
遠心処理による簡単な操作
高い通液性により高速処理が可能
シリカモノリス
100 µL以下の溶出量でも優れた再現性(S型) MonoSpin
操作方法
固相抽出における通液操作を短時間の遠心処理で行います。
ハンドリングを含めた処理時間は10分以内です。
遠心 遠心 遠心 遠心
コンディショニング 吸着 洗浄 溶出 遠心操作による処理
形状
MonoSpinシリーズは、最大800 µLまでのサンプルに最適なS型と、それよりも大きな1~8 mLのサンプルに最適な
L型、多検体処理用の96ウェルプレート型を用意しています。
官能基の種類によって対応できる形状が異なりますので、詳しくは4ページを参照してください。
S型 L型
● ディスクサイズ:Φ 4.2× 1.5 mm ● ディスクサイズ:Φ 9× 3 mm
● サンプル容量:800 µL まで ● サンプル容量:8 mL まで
● 溶出液量:50 ~ 800 μL ● 溶出液量:0.5 ~ 8 mL
● 使用時遠心力:2,000 ~ 10,000×g ● 使用時遠心力:1,000×g
注)MonoSpin ProA, MonoSpin ProG は
形状が異なります。 詳しくは16ページを
96 ウェルプレート型 参照してください。
●サンプル容量:800 μL まで
●溶出液量:50 〜 800 μL
●使用時遠心力:1,000 〜 5,000 ×g (減圧吸引法でも使用可能)
注)MonoSpin ProA, MonoSpin ProG は仕様が異なります。
詳しくは 16 ページを参照してください。
2
Page3
スライド番号 3
シリカモノリス ~粒子でも、メンブレンでもない新しい分離媒体~
シリカモノリスは、ケイ酸エチルから合成された均一な連続孔を有する一体型のシリカゲルです。粒子とは異なり
分離剤がディスク状に成型されています。シリカモノリスは貫通孔となるスルーポアと骨格表面にある微細な孔の
メソポアを持つため、高い通液性と大きな表面積を有します。そのため、高い捕集率と優れた吸脱着特性を有した
分離媒体として注目されています。
連続孔(スルーポア)
骨格に細孔(メソポア)
シリカモノリス構造
粒子充填タイプの前処理カラムと異なる点
ディスク状に成型されたシリカモノリスは、固相カラムなどの前処理カラムを作製する際、粒子を留めるための
フィルターを用いる必要がありません。また、非常に大きな表面積を有するため、分離剤のボリュームも小さくする
ことが可能です。そのため、溶液通過時にカラム内に液残りが生じにくく、試料液回収時に微量溶出も可能です。
また、高い通液性を有しているにもかかわらず、速い試料分散性、分離速度を有しているため、迅速処理に適した
分離媒体です。
シリカモノリス 粒子充填型
フィルター不要 フィルター必要なため
分離剤小型化 液残りが発生
分離剤のベッドボリューム : 小さい 分離剤のベッドボリューム : 大きい
カラム内の試料拡散 : 速い カラム内の試料拡散 : 遅い
分離速度 : 速い 分離速度 : 遅い
3
Page4
スライド番号 4
MonoSpin シリーズラインアップ
*
MonoSpin C18/C18 FF S L 96 MonoSpin Ph S
オクタデシル基を結合し、逆相分配相互作 フェニル基を化学修飾した逆相モードタイプ
用をもつカラムです。生体試料中薬剤の抽 です。C18より弱い疎水性を利用し、より選
出や、ペプチドサンプルの脱塩・濃縮に最 択性の高い前処理を行うことが可能です。
適です。ハイフロー(FF)仕様も用意してい 生体試料中からの疎水性薬物の回収に適
ます。 *:MonoSpin C18 FFはS型のみです。 しています。
MonoSpin C18-AX S 96 MonoSpin C18-CX S 96
オクタデシル基と4級アンモニウム基の両 オクタデシル基とベンゼンスルホン酸基を結合
方を化学修飾したミックスモードタイプで したカラムです。疎水性相互作用とイオン交換
す。高塩濃度生体試料でも確実にサンプ 作用が働きます。血清・尿中の解離している塩
-
基性薬物の精製に適しています。MonoSpin
ルを保持することができます。酸性薬物の
C18やSCX単体と比べ、高いクリーンアップ効
回収に適しています。
果があります。
MonoSpin SAX S L 96 MonoSpin SCX S L 96
4級アンモニウム基を結合したカラムです。 プロピルベンゼンスルホン酸を結合したカ
強陰イオン交換作用と弱い疎水性相互作 ラムです。強陽イオン交換作用と疎水性相
用を併せ持ちます。酸性薬剤などの抽出 互作用を併せ持ちます。塩基性化合物の
に最適です。 精製に最適です。
MonoSpin NH2 S L 96 MonoSpin CBA S L 96
アミノプロピル基を結合したカラムです。 カルボキシル基を結合したカラムです。
HILICモードによる、糖鎖や親水性化合物 強塩基性化合物の精製に最適です。
の精製・濃縮に最適です。
MonoSpin Amide S 96 MonoSpin PBA S 96
フェニルホウ酸を結合した選択性の高いカ
アミド基を結合したカラムです。HILICモード
ラムです。カテコールアミンなどのシス型ジ
による、糖鎖や酸性から塩基性まで幅広い
オールを有する化合物に対する選択的な
親水性化合物の抽出に最適です。
抽出に最適です。
MonoSpin TiO S MonoSpin Trypsin S
二酸化チタンをコーティングしたカラムです。 タンパク質消化酵素であるトリプシンを固
TiO2 リン酸基を有する化合物の抽出に最適です。 定化したカラムです。タンパク質の迅速消
化が可能になります。
MonoSpin ME S L MonoSpin Phospholipid S L ・・・・13ページ参照
TiO シリカモノリスに二酸化チタンと二酸化ジルコ
COOH 2
イミノ二酢酸基を結合したカラムです。 ニウムをコーティングしたリン脂質吸着用カラ
N ZrO2
試料中の微量金属の回収に最適です。 ムです。簡便な前処理により試料中の
COOH リン脂質を吸着することができます。
MonoSpin ProA S L 96 ・・・・16ページ参照 MonoSpin ProG S L 96 ・・・・16ページ参照
Protein A を固定化したアフィニティ担体で Protein G を固定化したアフィニティ担体
ProteinA す。迅速に抗体を精製することが可能です。 ProteinG です。迅速に抗体を精製することが可能
です。
S :S型カラム製品 L :L型カラム製品 96 :96ウェルプレート型製品
4
Page5
スライド番号 5
MonoSpin シリーズの特長
微量サンプルの精製、濃縮を実現
MonoSpinシリーズは高い通液性を有するため、遠心操作のみでサンプルの迅速な濃縮・精製が可能です。
また、少ない溶液量で溶出が可能であり、微量サンプルを希釈することなく回収できます。エバポレーションなどでの
濃縮・乾固の操作も不要です。
S型 MonoSpin PBAで精製
サンプル液量 500 µL
未処理 溶出量 500 µLの場合 溶出量 50 µL(10倍濃縮)の場合
Conditions
Column :Inertsil ODS-3 (5 µm, 150×2.1 mm I.D.) Col.Temp. :35 ℃
Eluent :50 mM Phosphate buffer (pH 5.6) Injection Vol. :5 µL
50 mg/L EDTA, 600 mg/L IPCC-008, -10% Methanol Detection :ECD Pulse Mode
Flow Rate :0.3 mL/min 前処理方法などは11ページを参照してください。
L型 血清試料をMonoSpin L C18 で精製
サンプル液量 5,000 μL
未処理
溶出量 500 μL (10倍濃縮)
0 2 4 6 8 10 0 2 4 6 8 10
Time (min) Time (min)
Conditions
Column :Inertsil ODS-3 (5 µm, 150×4.6 mm I.D.) Col.Temp. :40 ℃
Eluent :CH3CN/3 mM KH2PO4, 27 mM SDS= 48 / 52 Injection Vol. :1 µL
Flow Rate :1.0 mL/min Detection :230 nm
S型、L型 ともに高い濃縮効果が得られます。
5
0.00 0.10 0.20
0.00 0.10 0.20
Page6
スライド番号 6
各種MonoSpinにおける物性一覧
S型 / 96 well型 L型
表面積
品名 官能基 スルーポア メソポア スルーポア メソポア (m2/g) 負荷量(S型の場合)
(µm) (nm) (µm) (nm)
MonoSpin C18 オクタデシル基 5 10 10 10 350 100 μg アミトリプチリン
MonoSpin C18 FF オクタデシル基 20 15 10 10 300 50 μg アミトリプチリン
MonoSpin Ph フェニル基 5 10 ー ー 350 100 μg アミトリプチリン
MonoSpin C18-AX オクタデシル基、
4 5 10 ー ー 350 100 μg イブプロフェン
級アンモニウム
MonoSpin C18-CX オクタデシル基、 5 10 ー ー 350 100 μg アミトリプチリン
ベンゼンスルホン酸基
MonoSpin SAX トリメチルアミノプロピル基 5 10 10 10 350 100 μg イブプロフェン
MonoSpin SCX プロピルベンゼンスルホン酸基 5 10 10 10 350 100 μg アミトリプチリン
MonoSpin NH2 アミノプロピル基 5 10 10 10 350 100 μg マルトペンタオース
MonoSpin CBA カルボキシル基 5 10 10 10 350 100 μg アミトリプチリン
MonoSpin Amide アミド基 5 10 ー ー 350 100 μg アンジオテンシンⅡ
MonoSpin PBA フェニルホウ酸 5 10 ー ー 350 100 μg ドーパミン
MonoSpin TiO 二酸化チタン 20 15 ー ー 200 40 μg アデノシン一リン酸
MonoSpin Trypsin トリプシン 5 10 ー ー 100 ー ―
MonoSpin ME イミノ二酢酸基 5 10 10 10 350 25 μg Cuイオン
MonoSpin 二酸化チタン、
Phospholipid 5 10 10 10 350 10 μL ヒト血清
二酸化ジルコニウム
MonoSpin ProA Protein A 2 60 2 60 ー 400 μg ヒトIgG
MonoSpin ProG Protein G 2 60 2 60 ー 300 μg ヒトIgG
形状およびタイプに対する仕様
種類 MonoSpin S型*1 MonoSpin FF*2 MonoSpin L MonoSpin
型 96 ウェルプレート型
ディスクサイズ Φ4.2×1.5 mm Φ4.2×1.5 mm Φ9×3 mm Φ4.2×1.5 mm
サンプル溶液量 800 μLまで 800 μLまで 8 mLまで 800 μLまで
溶出液量 50~800 μL 50~800 μL 0.5~8 mL 100~800 μL
使用時遠心力 2,000~10,000 ×g 1,000 ×g 1,000 ×g 1,000~5,000 ×g
*1:MonoSpin ProA, MonoSpin ProG は仕様が異なります。詳しくは15ページを参照してください。
*2:FF仕様はMonoSpin C18 FFのみです。
適応サンプル
MonoSpinシリーズは、生体試料の前処理用スピンカラムとして最適化されています。血液など粘性の高いサンプルをご使用の場合
は、MonoSpin C18 FFを使用してください。サンプルの粘性、液量に応じてカラムを選択してください。
MonoSpin C18の適応サンプル 低 サンプル粘性 高
(例)尿 血清、血漿 全血
MonoSpin C18
(S型/ 96 ウェルプレート型)
MonoSpin C18 FF
MonoSpin C18 (L型)
注)MonoSpin FFにおいて、血液サンプルは20 μLまでを目途に使用してください。
6
Page7
スライド番号 7
アプリケーション
MonoSpin C18を用いた尿中アンフェタミン類の精製
サンプル溶液 800 µL
尿 400 µL
遠心 遠心 遠心 遠心
緩衝液(pH 13) 400 µL
各30 sec 1 min 1 min 1 min
溶液を混合し10,000 ×gで1分
遠心後の上清をサンプルとする。 1. コンディショニング 2. 吸着 3. 洗浄 4. 溶出 精製サンプル
①メタノール 300 µL サンプル溶 800 μL 緩衝液(pH 13) メタノール-0.1 %ギ酸
②緩衝液(pH 13) 300 μL 300 μL (1:1, v/v) 100 μL
遠心 : 5,000×g (①→遠心→②の順に操作)
3 Conditions
2 5
7 Column :InertSustainSwift C18 (3 μm, 150 × 2.1 mm I.D.)
Eluent :A)10 mM HCOONH4(pH 3.3)
B) CH3OH
4
6 A/B = 90/10 - 2 min - 90/10 - 13 min - 70/30, v/v
1 Flow Rate :0.3 mL/min
Col. Temp. :40 ℃
Detection :LC/MS
Sample : 1. Norephedrine 5. Methamphetamine
2. Ephedrine 6. 3,4-methylenedioxyamphetamine
3. Methylephedrine 7. 3,4-methylenedioxymethamphetamine
※データご提供:広島大学 奈女良先生 4. Amphetamine
MonoSpin C18を用いた生体試料中の薬物の回収
サンプル溶液 600 µL
血清 200 µL
10 mMリン酸カリウム 遠心 遠心 遠心 遠心
緩衝液(pH 7.0) 400 µL 各30 sec 2 min 1 min 1 min
溶液を混合し10,000 ×gで1分
1.コンディショニング 2.吸着 3.洗浄 4.溶出 精製サンプル
遠心後の上清をサンプルとする。
①メタノール 300 µL サンプル溶液 600 μL 水 300 μL アセトニトリル 200 μL
②10 mM リン酸カリウム
: 2,300 ×g 緩衝液(pH 7.0) 300 μL
遠心
(①→遠心→②の順に操作)
MonoSpin C18 を用いた血清中薬物の前処理 日間再現性(3days n=10)
Sample 濃度 回収率 RSD 濃度 回収率 RSD
(ng/mL) (%) (%) Sample (ng/mL) (%) (%) Sample 濃度 回収率 RSD
(ng/mL) (%) (%)
5 91.2 4.8 5 83.7 3.9 5 83.7 7.0
10 86.1 3.3 10 84.1 7.8 10 81.8 2.8
Desipramine Paroxetine Amitriptyline
50 85.2 5.9 50 83.9 8.2 50 83.8 3.0
250 88.4 6.5 250 86.7 7.5 250 88.4 2.7
5 96.3 9.5 5 85.7 8.1 5 97.9 9.0
10 95.8 1.5 10 84.7 3.2 10 95.5 8.5
Imipramine Maprotiline Sulpiride
50 94.5 0.9 50 88.6 5.4 50 90.8 2.6
250 95.9 0.9 250 87.5 7.7 250 92.6 3.0
5 96.8 11.6 5 106.3 9.9
10 87.1 5.0 10 104.8 6.7
Fluvoxamine Duloxetine
50 86.8 8.1 50 99.8 8.7 高い再現性をもって
250 87.5 9.7 250 99.8 6.0 処理することが可能です。
7
Page8
スライド番号 8
アプリケーション
MonoSpin C18を用いたタンパク質消化物の脱塩
サンプル溶液 最大 800 µL
トリプシン消化後のサンプルに 遠心 遠心 遠心 遠心
終濃度が0.1 %になるように
各1 min
TFA 2 min 1 min 2 min
を添加する。
1.コンディショニング 2.吸着 3.洗浄 4.溶出 脱塩サンプル
遠心 : 2,300 ×g ①アセトニトリル 200 µL サンプル溶液 0.1 %TFA水溶液 60 %アセトニトリル
②0.1 %TFA水溶液 200 µL 最大 800 μL 200 μL 200 μL
(①→遠心→②の順に操作)
Conditions
Column :Inertsil ODS-3
(3 μm, 150× 2.1 mm I.D.)
Eluent :A)H2O (0.1 % TFA)
B)CH3CN (0.1 % TFA)
A/B = 90/10 - 20 min - 50/50
Flow Rate :0.2 mL/min
Col. Temp. :40 ℃
Detection : UV 210 nm
Sample :Digested BSA 2 µL
MonoSpin C18 を用いることで、消化物中に
含まれる高濃度の変性剤、塩を除去すること
ができます。
MonoSpin Trypsin HPによるBSAの迅速消化
■還元アルキル化プロトコル例 Conditions
1 mg 牛血清アルブミン Column :Inertsil ODS-3
----- 500 mM Tris-HCl(pH 8.0) – 8 M 1 175 µL (3 μm, 150× 2.1 mm I.D.)
尿素(溶液 とする)
----- 40 mg/mL Eluent :A)H O (0.1 %HCOOH)
ジチオスレイトール in 溶液1 25 µL 2
----- Incubation at 37 ℃ 90 min B)CH3CN (0.1 %HCOOH)
----- 40 mg/mL in 1 50 µL A/B = 90/10 - 20 min - 50/50
ヨードアセトアミド 溶液
----- Incubation at 37 30 min Flow Rate :0.2 mL/min
℃ (遮光下で行う)
Col. Temp. :40 ℃
還元アルキル化タンパク質 250 µL
Detection :UV 210 nm
----- 50 mM 重炭酸アンモニウムで終濃度が
Sample :Digested BSA 2 µL
2 M 尿素になるように希釈(750 µL)
MonoSpin Trypsin HP 注)還元アルキル化の手法はタンパク質の種類などによって最適化してください。
●溶液消化 (37 ℃、10時間) ●MonoSpin Trypsin HPで消化 (室温25 ℃、10分)
トリプシン固定化スピンカラムで
室温・短時間(10分)の消化を実現できます。
注)消化には、必ず還元アルキル化処理後のタンパク質をサンプルとしてください。
8
Page9
スライド番号 9
アプリケーション
MonoSpin SCX を用いたタンパク質消化物の分画
2次元クロマトグラフィーのような複雑な装置を用いることなく、スピンカラムによる遠
心処理と塩濃度のステップ溶出により、ペプチドの分画処理を行うことができます。
サンプル溶液 500 µL
MonoSpin C18 で
脱塩後、0.1 % ギ酸で
遠心 遠心
再溶解したペプチド
30 sec 13 0m sinec
サンプル
1.コンディショニング 2.吸着 3.溶出
遠心 : 10,000 ×g 0.1 % ギ酸 300 μL ペプチドサンプル 500 μL
溶出液をアプライ、遠心後、新しい回収用チューブを装着して次の溶出液をアプライする。
各溶出液組成
①25 mM HCOONH4 200 µL ④500 mM HCOONH4 200 µL
②50 mM HCOONH4 200 µL ⑤1 M HCOONH4 200 µL
③100 mM HCOONH4 200 µL 注)各溶液とも10 %アセトニトリルを含む。
Conditions
Column : I nertsil ODS-3 (3 μm, 2.1 ×150 mm) Detection :UV 210 nm
Eluent : A )H2O (0.1 % HCOOH) Flow Rate :0.2 mL/min
B)CH3CN (0.1 % HCOOH) Col. Temp. :40 ℃ 塩濃度の異なる溶出液をアプライすることで
A/B = 90/10 - 20 min - 50/50 Injection Vol. :2 µL ペプチドサンプルの分画を行うことが可能です。
MonoSpin NH2を用いたピリジルアミノ化糖鎖の精製
サンプル溶液 800 µL
アセトニトリル終濃度が 遠心 遠心 遠心 遠心
90~95 %になるように 各1 min 1 min 1 min 1 min
サンプルを溶解
1.コンディショニング 2.吸着 3.洗浄 4.溶出 精製サンプル
遠心 : 2,300×g ①50 %アセトニトリル サンプル溶液 90 %アセトニトリル 50 %アセトニトリル
(0.1 % ギ酸*) 500 μL 800 μL (0.1 % ギ酸*) (0.1 % ギ酸*)
②90 %アセトニトリル 500 μL 50~800 μL
(0.1 % ギ酸*) 500 μL
(①→遠心→②の順に操作) *:添加する酸は、ギ酸の他、酢酸やTFAも使用可能です。
Conditions
Column :NH2 Column (5 μm, 250 × 4.6 mm I.D.)
Eluent :A)H2O/CH3CN
=5/95 0.1 % HCOOH
B) H2O/CH3CN
=95/5 0.1 % HCOOH
A/B = 90/10-10 min–90/10-40 min-60/40
Flow Rate :1 mL/min
Detection :FL Em 320 nm, Ex 400 nm
Injection Vol. :1.5 µL
9
Page10
スライド番号 10
アプリケーション
MonoSpin CBAによるパラコート、ジクワットの精製
サンプル溶液 600 µL
遠心 遠心 遠心 遠心
尿 200 µL
10 mM 30 sec 30 sec 30 sec×2回 30 sec
リン酸カリウム
緩衝液(pH 7.0) 400 µL 1.コンディショニング 2.吸着 3.洗浄 4.溶出 精製サンプル
10 mM リン酸カリウム サンプル溶液 10 mM リン酸カリウム 1 % 塩酸、30 % メタノール
緩衝液(pH 7.0) 200 µL 600 μL 緩衝液(pH 7.0) 200 µL 69 % 水 200 μL
遠心 : 10,000 ×g
Conditions
Column :Inertsil ODS-3
(5 μm, 150 mm× 4.6 mm I.D.)
Eluent :0.2 M H3PO4,
0.1 M (C2H5)2NH,
7.5 mM IPCC08(IPCC-0.8,
Sodium 1-Octanesulfonate)
/CH3CN=89/11
Flow Rate :1 mL/min
Col.Temp. :40 ℃
Detection :UV 290 nm
Injection Vol. :50 µL
MonoSpin C18を用いた血清中のホルモンの回収
サンプル調製
血清 190 µLに1 mg/mL
遠心 遠心 遠心 遠心
アドレノメデュリンを10 µL添加
各30 sec 1 min
↓ 1 min 1 min
0.1 %TFA水溶液を200 µL添加後、 1. コンディショニング 2. 吸着 3. 洗浄 4.溶出 精製サンプル
10,000 ×gで1分間 ①アセトニトリル 200 μL サンプル調製した 0.1 % TFA水溶液 0.1 % TFAを含む
②0.1 % TFA水溶液 200μL 上清 400 µL 200 µL 60 % アセトニトリル水溶液
遠心分離後の上清をサンプルとする。 (①→遠心→②の順に操作) 200 μL
遠心 : 2,300 ×g
Conditions
Column :InertSustain C18
( 2 μm, 50 ×2.1 mm I.D.)
アドレノメデュリン
Eluent :A)0.1 % TFA in H2O
B)0.1 % TFA in CH3CN
A/B = 85/15 – 5 min – 50/50
-2 min-50/50
Flow Rate :0.2 mL/min
Col. Temp. :40 ℃
Detection :UV 210 nm
Injection Vol. :10 μL
0 2 4 6
Time (min)
10
Page11
スライド番号 11
アプリケーション
MonoSpin PBAによるカテコールアミンの精製
サンプル溶液 250 µL
サンプル溶液
(尿もしくは血清) 200 µL 遠心 遠心 遠心 遠心
1 M リン酸水素二カリウム水溶液
(リン酸でpH 8.0 に調整) 50 µL 各1 min 1 min 1 min 1 min
1.コンディショニング 2.吸着 3.洗浄 4.溶出 精製サンプル
遠心 : 10,000 ×g ①1 % 酢酸水溶液 200 µL サンプル溶液 100 mM リン酸水素 1 % 酢酸水溶液
②100 mM リン酸水素 250 μL 二カリウム水溶液 200 μL
二カリウム水溶液 (リン酸でpH 8.0 に調整) 200 µL
(リン酸でpH 8.0 に調整) 200 µL
(①→遠心→②の順に操作)
Conditions
Column :Inertsil ODS-3
(5 μm, 150 mm×2.1 mm I.D.)
Eluent :50 mM Phosphate buffer (pH 5.6)
50 mg/L EDTA, 600 mg/L IPCC-008
-10 % CH3OH
Flow Rate :0.3 mL/min
Col. Temp.:35 ℃
Injection :5 µL
Detection. :ECD Pulse Mode
Sample :1. Noradrenaline
2. Adrenaline
3. DHBA
4. Dopamine
MonoSpin PBA を用いることで、カテコールアミンなどのシス型ジオールを有する化合物を選択的に回収、
精製することができます。詳細は弊社ホームページ「テクニカルノートLT093」を参照してください。
MonoSpin TiOを用いたヒト血清中の有機リン系農薬の精製
サンプル溶液 50 µL
サンプル 10 µL 遠心 遠心 遠心 遠心
各1 min 1 min×2回 各1 min 1 min
水 40 µL
1.コンディショニング 2.吸着 3.洗浄 4.溶出 精製サンプル
サンプル溶液 50 μL ①溶液 50 µL 2 % アンモニア水 N-acetyl-O-methyl 化
遠心 : 5,200×g ①80 % アセトニトリル(0.1 % TFA) 50 µL
②50 % アセトニトリル(0.1 % TFA) 50 µL →液を回収して再度 ②溶液 50 µL 50 μL してLC/MSへ
(①→遠心→②の順に操作) カラムにのせます (①→遠心→②の順に操作)
処理前 MonoSpin TiOで処理後 Conditions
Column :ODS Column (150 ×2.1 mm I.D.)
Eluent :A)CH3OH
B)20 mM HCOONH4 (pH 3.0)
A/B = 15/85, v/v
Flow Rate :0.2 mL/min
Detection :SIM
Injection Vol. :5 µL
Sample :1. Bialaphos
2. Glyphosate
3. MPPA
4. Glufosinate
MonoSpin TiO は化合物中のリン酸部位に対して選択性を示します。 5. AMPA
11
Page12
スライド番号 12
アプリケーション
タンパク質の回収、負荷量の確認
再吸着
サンプル調製
InsulinもしくはBSAを 遠心 遠心 遠心 遠心
0.1 % TFA水溶液で
各1 min 1 min 1 min 1 min
各濃度になるように調製する。
1. コンディショニング 2. 吸着 3. 洗浄 4.溶出 精製サンプル
遠心 : 2,000×g ①アセトニトリル 300 μL サンプル溶液 C H OH/H O/TFA
0.2 % TFA in H O 2 5 2
②0.2 % TFA in H2O 300 μL 2
300 µL =60:40:0.1 300 µL
300 µL
(①→遠心→②の順に操作)
Insulin 負荷量 負荷量オーバー BSA負荷量
MonoSpin C18を用いることで
最大負荷量 4 mg/mL 300 μL タンパク質の回収も簡便に行うことが
(サンプル量:1.2 mg)
90 % 負荷量オーバー
回収率 できます。
最大負荷量 0.1 mg/mL
(サンプル量:0.03 mg 詳細は弊社ホームページ 「テクニカル
)
回収率 86 % ノート LT157」を参照してください。
Concentration(mg/mL) Concentration(mg/mL)
MonoSpin C18FFを用いた全血サンプルの分析
サンプル調製
全血 0.3 mLと300 mM リン酸緩
遠心 遠心 遠心 遠心
衝液(pH 10.0) 1.2 mLを混合する。
1 min 1 min 1 min 1 min
↓
12,000 ×gで5分間 遠心分離後の 1. コンディショニング 2. 吸着 3. 洗浄 4.溶出 精製サンプル
①メタノール 300 μL サンプル調製した 300 mM リン酸緩衝液 メタノール 100 μL
上清をサンプルとする。
②300 mM リン酸緩衝液 上清 1 mL (pH 10.0) 300 µL
(pH 10.0) 300μL
(①→遠心→②の順に操作)
遠心 : 1,000 ×g
a-PBP
a-PPP (m/z 218)
2000000 (m/z 204)
a-PVP
1500000 (m/z 232) a-PHP
(m/z 246) a-PHPP
1000000 (m/z 260) a-POP
(m/z 274)
500000
0
5 10 15 20 25 min
Conditions
Column : InertSustain Phenyl (3 μm, 150 ×2.1 mm I.D.) Flow Rate : 0.2 mL/min
Eluent : CH3CN-HCOONH4(10 mM, 0.1 % HCOOH) = 25:75 (v/v) Col. Temp. : 40 ℃
Detection : MS(ESI)
12
Area
Area
Page13
スライド番号 13
リン脂質吸着用カラム MonoSpin Phospholipid
TiO MonoSpin Phospholipid は、優れたリン脂質吸着能力を有したスピンカラムです。
2
ZrO2 血清、血漿試料などを2ステップで簡便・確実に処理できます。
吸着したリン脂質は、回収用溶液をカラムへ流すことで回収することも可能です。
官能基 : 二酸化チタン、二酸化ジルコニウムコーティング カートリッジ形状 : S型、L型
トータルイオンクロマトグラム(処理方法の比較)
【特長】
簡単な操作で生体試料中のリン脂質を除去 除タンパク法で処理
(タンパク質を変性させて遠心し、
できます。
その上清を使用)
90 %以上のリン脂質を除去するため、
LC/MSにおけるマトリックス効果を低減でき
ます。
MonoSpin Phospholipidで処理
非常に微量な血清に対して適応することが 90 %以上のリン脂質を除去
できます。
吸着したリン脂質は回収することもできます。
Time (min)
吸着原理
金属酸化物とリン酸化合物の特異的な相互作用によってリン脂質が充填剤に保持されます。
疎水性 親水性
塩基
リン脂質 長鎖脂肪酸 グリセロール リン酸基
(極性イオン官能基)
相互作用
TiO2 ZrO2
Monolith
操作方法
サンプル調製
2 mLマイクロチューブに
遠心 遠心
0.1 % ギ酸-アセトニトリル:血清=4:1を混合
遠心 : 3,000 ×g
↓ 30 sec 30 sec
10,000 ×g で30秒間 遠心後の上清を 1. コンディショニング 2. 吸着 脂質除去後のサンプル
サンプルとする。 0.1 % ギ酸-アセトニトリル サンプル溶液 50 μL
200 μL
*吸着したリン脂質はアンモニア-メタノール溶液により回収することが可能です。
関連製品
FastRemover for Phospholipid
ろ過による除タンパク処理ができ、リン脂質を除去する機能を持つ96ウェルフィルタープレート
製品も用意しています。詳細はお問い合わせください。
13
Intensity, cps
Page14
スライド番号 14
アプリケーション参考文献
種類 対象成分 参考文献
[1-(5-fluoropentyl)-1H-indol-3-yl](4-methyl-1-naphthalenyl)methanone
(MAM-2201) Forensic Toxicol., 2013, 31(2), 333–337
α-Pyrrolidinovalerophenone Forensic Toxicol., 2014, 32(1), 68–74
25-Hydroxyvitamin D3 Anal. Sci., 2018, 34(9), 1043-1047
Aconitines and Colchicine Chromatographia, 2015, 78(15), 1041–1048
Amphetamines J. Chromatogr. A, 2008, 1208(1-2), 71-75
Amphetamines Anal. Chim. Acta, 2010, 661(1), 42-46
a-Pyrrolidinovalerophenone (a-PVP) and a-pyrrolidinobutiophenone
(a-PBP) Forensic Toxicol., 2014, 32, 68-74
Desalting Amino Acids., 2018, 50(1), 117–124
Desalting Org. Biomol. Chem., 2018, 17(1), 165-171
Desalting J. Proteomics, 2018, 181, 238-248
Desalting J. Pept. Sci., 2018, 24(12), e3133
Desalting of LaIT1 Mass Spectrometry, 2017, 6(1), A0059
Desalting of LaIT1 J. Pept. Sci., 2015, 21(8), 636-643
Dibucaine、Naphazoline J. Chromatogr. B, 2008, 872, (1-2), 186-190
Diquat, Paraquat Anal. Bioanal. Chem., 2011, 400(1), 25–31
Diquat, Paraquat Anal. Bioanal. Chem., 2011, 400(1), 25-31
Drugs J. Chromatogr. B, 2008, 867(1), 99-104
Drugs Chromatographia, 2009, 70(3), 519-526
Eperisone, Tolperisone J.Health Sci., 2010, 56(5), 598-605
Eperisone, Tolperisone, and Tizanidine J.AOAC Int. 2014, 97(6), 1546-1551
Flavonoid J. Chem. Ecol. 2016, 42(12), 1226-1236
glucocorticoids J. Chromatogr. B, 2017, 1057, 62-69
Iodide Am. J. Mod. Chromatogr., 2015, 2(1), 1-6
iTRAQ labeled desalting Int. J. Oncol., 2015, 47(1), 384-390
Liraglutide J. Chromatogr. B, 2018, 109, 29-35
MAM-2201 Forensic Toxicology. 2013, 31(2), 333–337
Medicinal toxicants J. Clin. Pharm. Ther., 2017, 42(4), 454-460
N-1-Naphthalenyl-1-pentyl-1H-indole-3-carboxamide Forensic Toxicol., 2015, 33(1), 165–169
C18 Nanoparticles J. Chromatogr. A, 2015, 1404, 141-145
Naringin J. Clin. Pharmacol., 2013, 53(7), 738-745
Organophosphorus compounds Anal. Sci., 2011, 27(10), 999-1005
Oxidized phospholipids J. Lipid. Res., 2017, 58(11), 2229-2237
oxPUFAs Sci. Rep., 2018, 8, 7954
Peptides Cancer Res., 2017, 77(4), 926-936
Peptides Bio protocol. 2015, 5(8), 2015
Peptides Clin. Exp. Nephrol., 2018, 22(4), 782–788
Peptides Biosci. Biotechnol. Biochem., 2017, 81(12), 2237-2243
Peptides Methods Mol. Biol. 2018, 1696, 91-105
Peptides Biosci. Biotechnol. Biochem., 2018, 82(8), 1309-1315
Peptides Data Brief., 2018, 31(17), 604-609
Peptides Data Brief., 2017, 12(11), 252-257
Peptides Bioresour. Technol., 2018, 254, 278-283
Peptides Biomass Bioenergy, 2016, 91, 83-90
Peptides Neurogenetics, 2019, 20(1), 9-25
Peptides J. Proteomics, 2015, 119, 183-195
Peptides Proc. Natl. Acad. Sci., 2018, 115(14), 3646-3651
Peptides Oncogene, 2017, 36(26), 3740-3748. doi: 10.1038/onc.2016.524
Peptides Sci. Rep., 2018, 22, 8(1), 1303
Peptides Sci. Rep., 2016, 6, 26723
Peptides Proteomics, 2013, 13(5), 751-755
Peptides J. Proteomics., 2013, 84(12), 40-51
Phthalate esters J. Pharm. Anal., 2011, 1(2), 92-99
Phthalates J. Pharm. Anal., 2011, 1(2), 92-99
Plant samples Sci. Rep., 2017, 7(1), 1243. doi: 10.1038/s41598-017-01390-3
Purines Nucleosides Nucleotides Nucleic Acids, 2018, 37(6), 348-352
Pyrrolidinophenone type designer J. Chromatogr. B, 2013, 30, 942-943
Pyrrolidinophenone-type designer drugs J. Chromatogr. B, 2013, 942-943, 15-20
review Bioanalysis., 2015, 7(17), 2171-2176
14
Page15
スライド番号 15
アプリケーション参考文献
種類 対象成分 参考文献
C18 FF Drugs J. Chromatogr. A, 2017, 1517, 9-17
C18, C18CX Cardiovascular drug Acta Chromatographica, https://doi.org/10.1556/1326.2018.00493
Melamine J. Anal. Sci. Meth. Instrum., 2012, 2, 68-73
C18, SCX
Peptides Sci. Rep., 2017, 7(1), 11137
C18, TiO Peptides Int. J. Mol. Sci., 2018, 19(9), 2655
C18, SAX Aamphetamines, Opiates, and THC Forensic Toxicol., 2013, 31(2), 312–321
C18-AX Oxidized Fatty Acids Mod. Chem. Appl., 2015, 3, 3
Arsenite, Arsenate, and Methylarsenate J. Sep. Sci., 2012, 35(18), 2506-2513
C18-CX Clean up J. Occup. Health., 2018, 60(2), 140-147
Drugs J. Sep. Sci., 2011, 34(16-17), 2232-2239
Halogenated compounds Toxicology, 2013, 314(1), 22-9
Amide PA-labelled glycans Bicsci. Biotechnol. Biochem., 2012, 76(10), 1982-1983
CBA clenbuterol Talanta, 2018, 186, 521-526
CBA, Amide Tetrodotoxin Chromatographia, 2014, 77, (9-10), 687–693
nanoparticles J. Sep. Sci., 2015, 38, 283–290
Oligosaccharides Sci Rep. 2017, 26(7) :46099. doi
NH2 PA labeled N-glycans Glycoconj. J., 2017, 34(4), 537-544
PA-labelled glycans Plant Biotechnol. J., 2016, 14(8), 1682-1694
Pyridylaminated Oligosaccharides Anal. Sci., 2016, 32(5), 487-490
Adenosine Biosens. Bioelectron., 2013, 15(41), 379-385
Allergenic ingredients Food Control, 2018, 84, 89-96
Catecholamines J. Comp. Neurol., 2016, 524(18), 3849-3864
Catecholamines Food Chem., 2019, 276, 376-382
Catecholamines EBioMedicine., 2016, 8, 60-71
Catecholamines PLoS One, 2018, 13(7), e0201203
PBA Catecholamines J. Chromatogr. B, 2015, 985, 142-148
Catecholamines Biol. Pharm. Bull., 2017, 40(2), 227-233
Catecholamines Biosci. Biotechnol. Biochem., 2018, 82(3), 497-506
Cis-diol groups Anal. Chim. Acta., 2015, 857(1), 64-70
hippocampal monoamines J. Pharmacol. Sci., 2016, 132(4), 249-254
Pyridylamino monosaccharide Bicsci. Biotechnol. Biochem., 2011, 75(7), 1405-1407
Serotonine and Noradrenaline Br. J. Pharmacol., 2015, 172(5), 1250-1262
Phospholipid Farnesyl pyrophosphate Anal. Bioanal. Chem., 2017, 409(14), 3551–3560
ProteinA, G IgG Biochimie., 2018, 145, 113-124
IgG Virology, 2019, 15, 527, 132-140
ProteinG IgG PLoS One, 2017, 12(7):e0181181
IgG Bioanalysis, 2018, 10(18), 1501-1510
Alendronate Legal. Medicine, 2018, 30, 14-20
SAX Deoxyribonucleoside Biotechnol., 2016, 228, 52-57.
metabolite of 18 F-THK5351 Eur. J. Nucl. Med. Mol. Imaging, 2016, 43(12), 2211-2218
Urinary excretion Nucleosides Nucleotides Nucleic Acids. 2016, 35(10-12), 559-565.
Amino acid Psychiatry Res., 2016, 238, 203-210
Amino acid J. Sep. Sci., 2014, 37(16), 2087-2094
Amino acid Sci. Rep., 2018, 8(1), 14587
Amino acid Orig. Life Evol. Biosph., 2013, 43(2), 99-108
SCX Angiogenic peptide BioSci. Trends, 2016, 10(6), 500-506
Fluoresence derivatization Biomed. Chromatogr., 2012, 26(2), 147-151
iTRAQ-labeled peptides Biochim. Biophys. Acta, 2018, 1865(6), 874-888
Methylated lysine Anal. Bioanal. Chem., 2018, 410(17), 4189–4194
Morphine, Codeine, Dihydrocodeine J. AOAC Int., 2011, 94(3), 765-774.
TiO Glyphosate Acta Chromatographica, https://doi.org/10.1556/1326.2018.00513
Protein digestion J. Am. Chem. Soc., 2018, 140(38), 11982-11991
Trypsin
Protein digestion Anal. Sci., 2018, 34(4), 397-406
review Forensic Toxicol., 2010, 28(2), 61–68
review Trac. Trends Anal. Chem., 2013, 45, 182-196
review Electrophoresis. 2017, 38(22-23), 2851-2869
review Chromatogr., 2015, 2(1), 79-95
review J. Pharm. Biomed. Anal., 2018, 161, 51-60
15
Page16
スライド番号 16
抗体精製用カラム MonoSpin ProA, MonoSpin ProG
シリカモノリスの表面に抗体精製用のアフィニティリガンドが修飾され
ており、抗体試料の高速精製を可能にします。硬質のゲルを使用して
いるので通液速度が上げられ、短時間での精製が実現できます。
スピンカラムタイプ、96ウェルプレートタイプをラインアップしています。
製品には、精製に必要な各種試薬が付属しています。
【特長】
Protein AとProtein Gの2種類の抗体アフィニティリガンドを用意しており、目的の抗体に合わせて選択できます。
担体としてシリカモノリスを用いるため、高速処理においてもしっかりと目的抗体を保持し回収することが可能です。
溶出時に酸に暴露する時間も短いため、抗体が酸により変性するリスクも大幅に軽減することも可能です。
【仕様】
スルーポア : 2 µm
ProteinA
メソポア : 60 nm
ディスクサイズ : Φ 4.2 ×1.5 mm
親水性ポリマー サンプル溶液量 : 500 μLまで
溶出液量 : 50 μL
Protein A, Protein G *
を固定化しているシリカモノリス表面は、 使用時遠心力 : 2,300 ×g
親水性ポリマーが修飾されており、タンパク質の非特異吸着 サンプル負荷量 : 400 μg (ヒトIgG)
*:96ウェルプレートタイプは減圧吸引(例:-0.015 MPa)でも使用できます。
を抑制し、より純度の高い抗体の回収を可能とします。
形状
スピンカラムタイプ 96 ウェルプレートタイプ
・卓上遠心機(例:2,300×g)約2分で精製可能です。 ・プレート下面を減圧吸引、または遠心操作で精製します。
・0.4 mg(負荷量)までの少量の精製に適応します。 ・Spinタイプと同じ容量で、より多検体の精製に使用できます。
ラージスピンカラムタイプ
・1本で約16 mgまでの抗体を遠心処理により回収可能です。
・固相マニホールドによる吸引処理により数百mLのサンプルを数分で処理することが可能です。
16
Page17
スライド番号 17
抗体精製用カラム MonoSpin ProA, MonoSpin ProG
超高速処理で安定した回収を実現
シリカモノリスを用いることで卓上遠心機での短時間の遠心操作により、簡便に抗体を精製することが可能です。
抗体回収時には、中和溶液をあらかじめ回収用チューブへ入れておくことで、酸により回収した抗体を即座に中和することがで
きます。そのため、抗体の変性のリスクを大幅に下げられます。
遠心 遠心 遠心 遠心
30 sec 30 sec 30 sec 30 sec
1. コンディショニング 2. 吸着 3. 洗浄 4.溶出 精製液
遠心 : 2,300 ×g
CHO細胞の培養液から定量的に抗体濃度を測定した結果を下図に示しています。
精製された抗体は電気泳動の結果から、不純物をほとんど含んでいないことがわかります。
抗体濃度の測定 回収液電気泳動結果例
0.6
回収したポリクローナル 1 2 3 4 5 6
ヒトIgG抗体
0.5
97.4 kDa 1. マーカー
66.2 kDa
0.4 2. 培養液
45.0 kDa 3. フロースルー
0.3 4. 洗浄
31.0 kDa
0.2 5. 溶出
21.5 kDa 6. 再生
0.1
14.4 kDa
0
0 0.2 0.4 0.6
抗体体添添加加量量(mgm) g
MonoSpin ProAによる抗体溶液の濃縮
原液( ヒトIgG 0.025 mg/mL)の抗体溶液 500 μLをカラムに連続的に10回アプライし、溶出液量100 μLで2回溶出し、各溶
出液の抗体濃度を確認しました。溶出1回目において得られる抗体濃度は原液の50倍に濃縮されており、90 %以上が回収
されています。通過液画分、洗浄画分には抗体の漏出はほとんど見られません。
17
抗抗体体回回収収量量 (mmgg)
Page18
スライド番号 18
MonoSpin ProA, MonoSpin ProG
溶出液量と抗体回収率の関係 他社製品との比較
MonoSpin ProAでは100 µLの溶出液量で90 %以上の回収率を示します。他社製品では、400 µL以上の溶出液量を必要とす
るため、回収液は希釈されてしまいます。また回収率も70 %以下です。
溶出液量
400 μL
MonoSpin ProA 200 μL
100 μLで回収率90 %以上
100 μL
T社製品 400 μL
400 μLで回収率65 %
200 μL
200 μLでは1回目の溶出で
回収できない 100 μL ※ ※溶出液が回収できませんでした。
G 400 μL
社製品
溶出液が少ないと回収率低下 200 μL
400 μLで回収率70 % 100 μL
回収率(%)
市販抗体溶液中の保存剤の除去
IgG+BSA IgG+Gelatin
0.10 チャンネル A -- SチPャンDネ-2ル0A -- SPD-20A 0.10
2 チャンネル A -- チSャPンDネ-2ル0A -- SPD-20A
MonoSpin処理前
0.04 MonoSpin処理前
0.08 0.04
0.08 MonoSpin処理後 MonoSpin処理後
2 1
3
0.06 0.06
1 : IgG 1 : IgG
2 : BSA 0.02 2 : Gelatin 0.02
1 3 : Elution Buffer 3 : Elution Buffer
0.04 3 0.04
0.02 0.02
0.00 0.00
0.00 0.00
0 2 4 6 8 10 12 14 16 18 20 0 2 4 6 8 10 12 14 16 18 20
Time(min) Time(min)
BSAやゼラチンなど、市販抗体溶液に含まれるタンパク質は抗体の誘導体化時にはあらかじめ除去する必要があります。
MonoSpin ProA/ProGを用いることで、抗体溶液を希釈することなく精製することが可能です。
18
Volts
Volts
Volts
Volts
Page19
スライド番号 19
MonoSpin ProA, MonoSpin ProG
CHO細胞培養液からの抗体の回収(96ウェルプレート)
96サンプルの処理においても安定した回収率、再現性を得ることができます。
ウェル番号
サンプル量 : 150 μL(96ウェルプレートにおいて同じサンプルを精製)
溶出液量 : 150 μL
平均値 : 回収率 90 % (CV 3.1 %)、抗体濃度 1.3 mg/mL
MonoSpin L ProAカラムによる多量抗体サンプルの精製手法
操作方法
1.平衡化バッファーを5 mLカラムにアプライする
2.サンプルを最大8 mL添加する
*0.2 μmフィルターで処理した後のサンプルを用いてください。
3.洗浄バッファーを5 mLカラムにアプライする。
4.溶出バッファーを5 mLカラムにアプライする。
各工程における遠心処理 : 1500 ×g, 2 min
*各種バッファーは準備もしくはMonoSpin ProA/G buffer kitを使用
遠心法もしくは、吸引法により16 mgの抗体を簡便に精製することが可能です。
19
吸光度 (Abs)
Page20
スライド番号 20
MonoSpin 96 well plate
MonoSpin 96WPは、シリカモノリスディスクを固定化した、多検体前処理用プレートです。
これまでにMonoSpinで使用していたモノリスディスクと同じディスクを固定化しており、スピンカラム使用時と同
様の負荷量、結果が得られやすい仕様に設計しています。
MonoSpin MonoSpin 96WP
シリカモノリスゲル
【特長】
MonoSpinスピンカラムと同じゲルを96ウェルプレートへ固定
遠心もしくは吸引(-0.05 MPa以上推奨)での使用が可能
生体試料の迅速前処理が可能
スピンカラムと同様の溶液組成での処理が可能
ラインアップが豊富
【豊富なアプリケーション】
ペプチドサンプルの脱塩精製、分画 生体試料中(尿、血清、血漿)からの薬物の回収
タンパク質の回収、精製 カテコールアミンの精製
iTRAQ誘導体化後の精製 有機酸の回収、精製
糖鎖の精製
品 名 入 数 Cat.No. 価 格
MonoSpin 96WP C18 1枚 5010-21900 43,000
MonoSpin 96WP NH2 1枚 5010-21901 43,000
MonoSpin 96WP PBA 1枚 5010-21902 50,000
MonoSpin 96WP SAX 1枚 5010-21903 43,000
MonoSpin 96WP SCX 1枚 5010-21904 43,000
MonoSpin 96WP Amide 1枚 5010-21905 43,000
MonoSpin 96WP CBA 1枚 5010-21906 43,000
MonoSpin 96WP C18-CX 1枚 5010-21907 43,000
MonoSpin 96WP C18-AX 1枚 5010-21908 43,000
20